足球篮球直播平台
>
科技研发 > 研发动态
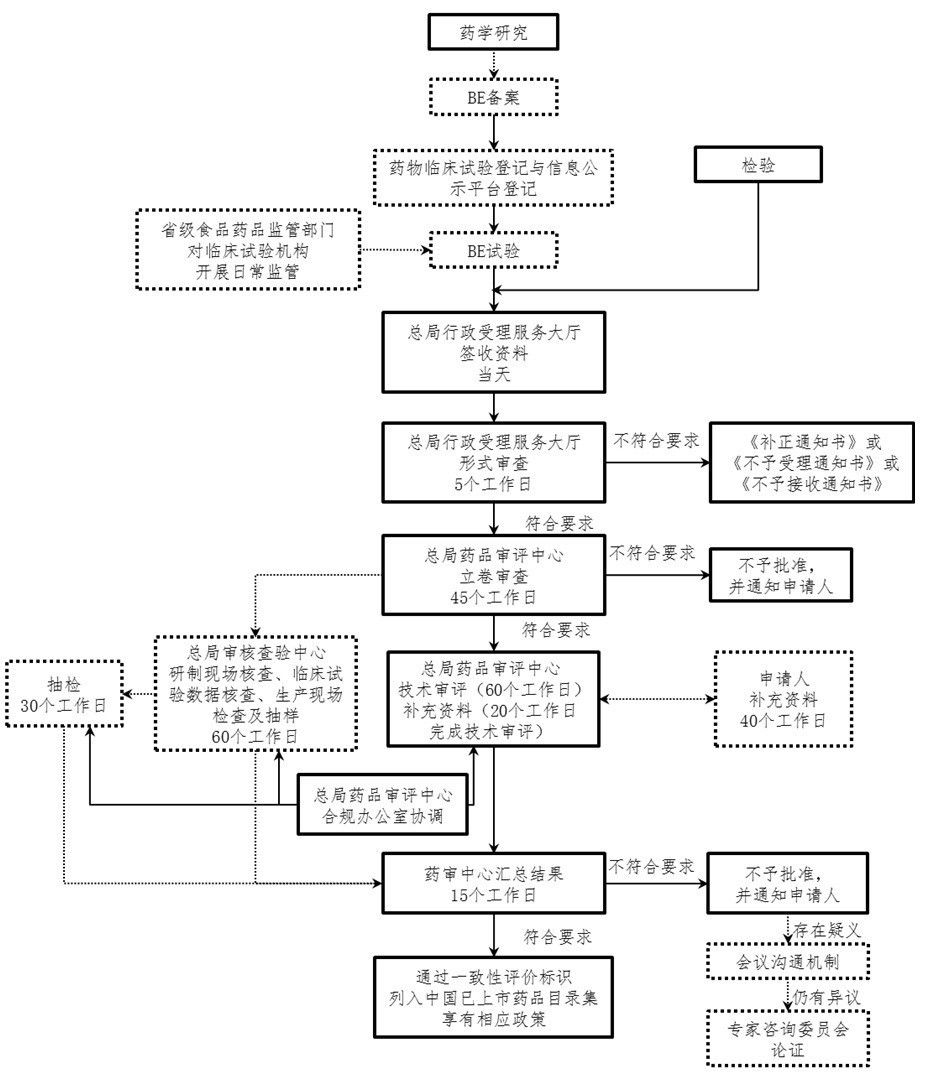
CFDA发布一致性评价申报流程
来源:信息员 点击量:4061 时间:2017-06-12
6月9日,《并于仿制药高安全性能和药效不对性评判本职工作有关的信息作用的公告信息(征得起草说明)》《仿制药高安全性能和药效不对性评判结案审察指导具体指导提出的意见(需不对性评判种类)(征得起草说明)》《仿制药高安全性能和药效不对性评判结案审察指导具体指导提出的意见(国内共线产出并在美国以及欧洲等日退市种类)(征得起草说明)》同一用时在CFDA联系电话挂出,征询具体指导提出的意见征得用时到12月9日。